視線保持に関わる
神経メカニズムの解明
本講座では「視線保持に関わる神経メカニズムの解明」を目指し、遺伝子改変動物を用いたスライスパッチクランプ法や神経連絡解析法など、電気生理学的、形態学的、分子生物学的手法を駆使して研究を行っています。
今後は、RNA-Seq法などにより視線保持に関与する遺伝子の発現量解析やこれまで得られた知見をもとにした行動学的解析によって、さらに視線保持のメカニズムに迫っていこうと考えています。
(解説) 視覚は我々ヒトを含めた高等動物にとって特に重要な感覚です。
しかし、網膜の高解像度の領域は限定されており、また、その領域で光を感受するためには一定時間必要となります。
従って、視覚情報を適切に脳に取り込むためには、網膜の高解像度の領域を視覚対象に向ける、つまり、視線を視覚対象へ向けて一定時間保持することが必要です。
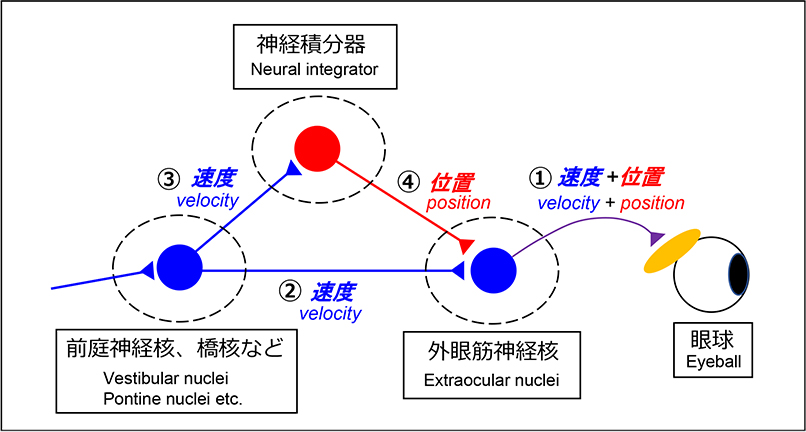
そのためには、眼球を回転させて視覚対象の方向に眼球を保持する必要があることから、外眼筋(眼球を動かす筋肉)へ指令を送る外眼筋運動ニューロンは、「眼球を動かすための情報」と「眼球を保持するための情報」を外眼筋へ伝えます。
このときの「眼球を動かすための神経活動」は眼球の回転速度に比例し、「眼球を保持するための活動」は眼球の位置に比例することが知られています。
つまり、外眼筋運動ニューロンは眼球の速度情報と位置情報をコードしています(図1-①)。
一方で、外眼筋運動ニューロンへ指令を送り、眼球運動の発現に関与する橋網様体や前庭神経核などの脳幹ニューロンは、頭部または眼球の回転速度に比例した情報のみをコードしています(図1-②)。
従って、脳幹ニューロンから外眼筋運動ニューロンへ信号が伝えられる間に、速度情報(図1-③)を位置情報(図1-④)へ変換させる必要があります。
この速度から位置への変換は数学的には時間積分に相当するため、この変換に関与する脳領域は神経積分器(neural integrator)と呼ばれています。
図1
これまでの研究により、水平性の視線保持に関与する神経積分器は脳幹の舌下神経前位核(Prepositus Hypoglossi Nucleus、以下PHNと略す)を中心とする領域、垂直性の神経積分器はカハール間質核(Interstitial Nucleus of Cajal、以下INCと略す)を中心とする領域、であることが示唆されています。
神経積分器のメカニズムについては理論的な研究により様々なモデルが提唱されてはいますが、生体内での神経積分器の実体については不明のままです。
我々は神経積分器の実体に迫るため、「神経積分器はどのようなニューロンや神経ネットワークによって構成されており、神経積分器を介した速度-位置変換がどのようなメカニズムにより実現されているのか」という学術的な問いに対し答えを得る必要があります。
PHNやINCに関する研究については、サルを使ったシステムレベルの研究やコンピュータシュミレーションによるモデル研究が行われており、視線保持のメカニズムには神経積分器内の興奮性ネットワークの活性化や小脳との相互ネットワークなどが重要であることが示唆されてきました。
しかし、そのメカニズムを明らかにするにはニューロンやネットワークレベルの知見が必要ですが、これまでスライス標本などを用いて行われた研究は乏しいのが現状です。
その理由の一つとして、眼の動きを直接計測する行動学的解析以外に神経積分器の機能を正確に評価する指標がなかったことが挙げられます。
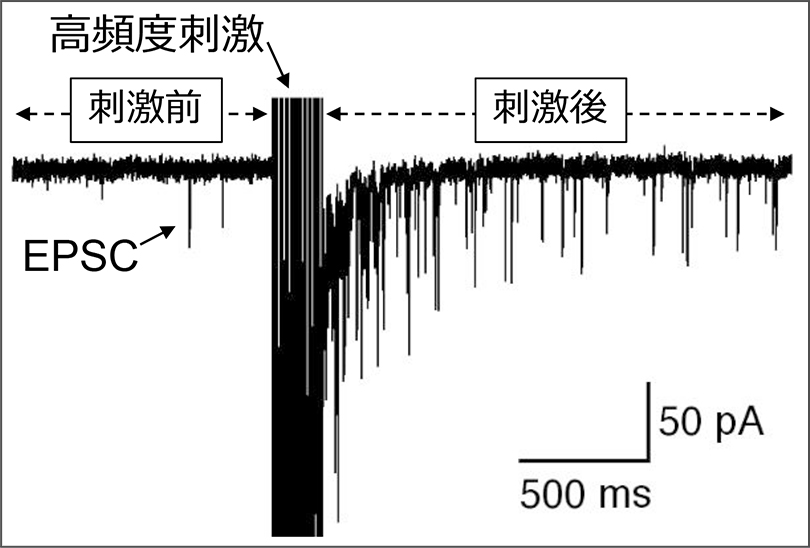
我々は、PHNを含むスライス標本において、記録しているニューロンの近傍に一過性の高頻度刺激を与えると、興奮性シナプス後電流(EPSC)の頻度が刺激前に比べて大きく増加し、それが数秒間持続される現象(持続性EPSC応答、図2)を見出しました。
その後の解析によって、この応答はPHN内の興奮性ネットワークの持続的な活性化によることが明らかになりました。
この研究により、神経積分器内の興奮性ネットワークの活性化の様子がin vitroにおいて初めて明らかにされるとともに、持続性EPSC応答をもとに神経積分器の機能を評価できることが判明しました。
図2
PHN内の興奮性ネットワークの活性化が「持続的」であるためには、活性化を下支えするメカニズムが必要です。
我々は、様々な神経伝達物質受容体の阻害薬を用いた薬理学的解析により、グルタミン酸受容体の一つであるカルシウム透過型AMPA受容体(CP-AMPA受容体)がPHNニューロンに発現しており、高頻度刺激によってこの受容体が活性化されて細胞内にカルシウムイオンが流入し、その結果、示すカルシウム依存性非選択的陽イオンチャネル(CANチャネル)を活性化することによって、持続性EPSC応答が生じることを明らかにしました(図3-①)。
このような解析を垂直性の神経積分器であるINCにおいても行ったところ、やはり持続性EPSC応答が観察され、INC内の興奮性ネットワークの持続的な活性化が明らかになりました。
しかし、薬理学的解析を行った結果、INCでの持続的な活性化のメカニズムがPHNと異なっており、主にNMDA受容体の活性化によって生じていることが明らかになりました(図3-②)。
図3
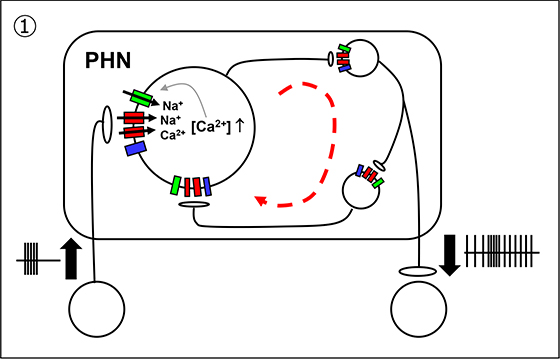
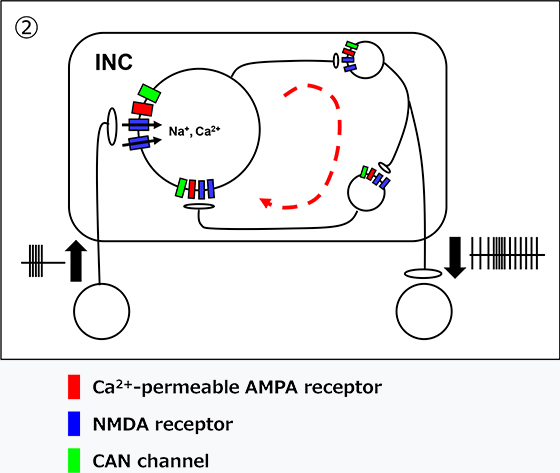
このように、水平性と垂直性の神経積分器で異なるメカニズムにより興奮性ネットワークが活性化されることを世界に先駆けて報告し、注目論文として国際科学雑誌のホームページで紹介されました(eNeuro. Jan. 31, 2020)。
これまで得られた成果から、視線保持のメカニズムとして神経積分器内の興奮性ネットワークの活性化が挙げられますが、一方で、これだけではメカニズム全容が明らかになったわけではありません。
神経積分器と小脳とのネットワーク様式やアセチルコリンやセロトニンなどによる神経積分器に修飾様式などもメカニズムとして挙げられます。
我々は現在これらの課題についても研究を行っております。
(関連論文)
Saito Y, Sugimura T (2019) Different activation mechanisms of excitatory networks in the rat oculomotor integrators for vertical and horizontal gaze holding.
eNeuro 7 January/February 2020.
doi: 10.1523/ENEURO.0364-19.2019
Saito Y, Sugimura T, Yanagawa Y (2017) Comparisons of neuronal and excitatory network properties between the rat brainstem nuclei that participate in vertical and horizontal gaze holding. eNeuro 4 September/October 2017.
doi: 10.1523/ENEURO.0180-17.2017.
Saito Y, Yanagawa Y (2010) Synaptic mechanism for the sustained activation of oculomotor integrator circuits in the rat prepositus hypoglossi nucleus: Contribution of Ca2+-permeable AMPA receptors.
Journal of Neuroscience 30: 15735-15746.
doi: 10.1523/JNEUROSCI.2814-10.2010
